【この記事は 第65回日本糖尿病学会 年次学術集会に参加したしらねのぞるばの 手元メモを基にした感想です. 聞き間違い/見間違いによる不正確な点があるかもしれませんが,ご容赦願います】
薬物実験の論文を読んでいると,”in Vivo” と “in Vitro“という言葉に出くわします.
in Vivo
in Vivoの Vivoはラテン語で『生きる,生きている』という意味だそうです[★]
薬物の作用や効果を調べるために,生きているマウスやラットに投与して反応を見る実験は in Vivo(生体実験)です.
[★] ビバ! = Viva!(万歳!)もここから来ています.
in Vitro
これに対して in Vitro とは,生物ではなく,試験管や培養シャーレの中で,動物の細胞などを培養しておき,これに薬物などを投入してその変化を観察する実験です. Vitroとはラテン語で『グラス,コップ』の意味なので,『試験管での実験』を表しているわけです.結果がわかりやすい実験ですが,ここで見られた変化が 必ずしも生体内で同様に起こるとは限りません.
新型コロナ流行の初期に,『新型コロナウイルスの入った液体に XXX化合物を投入したら,すぐに死滅した. XXXは新型コロナの特効薬だ!』などという報道がありましたが,これが典型的な in Vitroです.
インシリコ = in Silico
今回の学会でこういうシンポジウムが行われました.
シンポジウム16
『ビッグデータとスーパーコンピューターが切り拓く生命科学の現在と未来』
S16-1 システム医学の実現に向けて~睡眠科学を例に~
S16-2 遺伝統計学による病態解明・創薬・個別化医療
S16-3 細胞アトラスと計算生命科学による疾患の克服
S16-4 インシリコ創薬研究の高度化と支援
最初の3題の講演は ド素人のぞるばにも何となく内容の想像がつきましたが,4題目の『インシリコ』って???
講演を聴いて この言葉の意味がわかりました. つまり;
- in Vivo 生体実験
- in Vitro 試験管実験
- in Silico Silico = Silicon Chip = コンピュータ実験
ということでした.マウスも培養細胞も使わず,すべてコンピュータ上の計算で実験してしまおうぜ,という実験のことでした.
『そうか,そうか コンピュータ シミュレーションのことね』と合点していましたが,話を聴いて度肝を抜かれました.すごいのですよ,これが.
Alpha Fold
まず Alpha Fold というコンピュータソフトの解説がありました.
このソフトウエアは,蛋白質のアミノ酸配列データを与えてやると,その蛋白質の立体構造を数値決定してくれます.

従来 蛋白質の立体構造を知ることは 非常に手間が,したがって時間とお金がかかる作業でした.まずその蛋白質を極限まで精製し,純粋な結晶にして(これが非常に大変),X線回折により,蛋白質を構成する個々の原子の空間配置を決定していきます. 無機物の結晶(たとえばダイヤモンドなど)であれば,これは簡単です.私も学生実験でやりました. また最近では極低温電子顕微鏡で直接蛋白質の構造を観測するという方法もあります.しかし とてつもなく複雑な構造をした蛋白質では,時に何年もかかることも珍しくはありません. いまだに立体構造が不明というものもあります.
ところが Alpha Foldは,下図のように蛋白質のアミノ酸配列(これは比較的簡単にわかります)をデータとして放り込んでやれば(下図:最左),その蛋白質の立体構造を算出してくれます(下図:最右). もちろん立体構造が既知の類似物質のデータなども参考にはしているのですが,基本的には 各原子がどの位置にあれば,もっとも安定な状態になるかをひたすら Try&Errorで計算していくわけです.膨大な計算であり,人間にはとても不可能ですから,コンピュータ,それもスパコンが必須です.
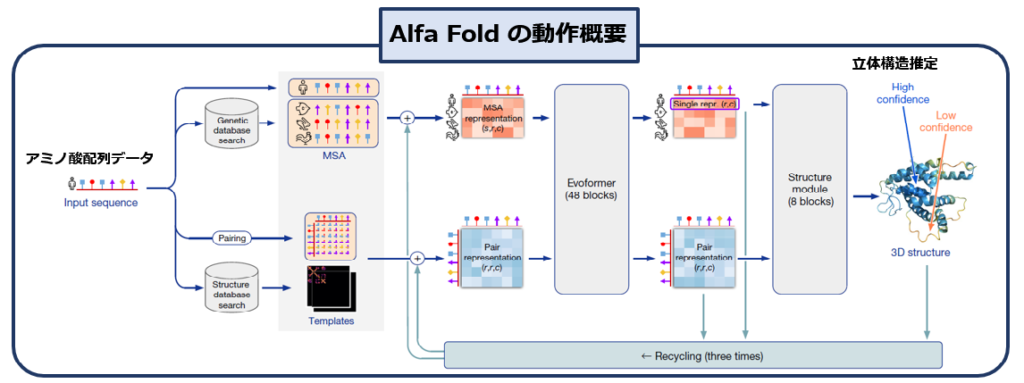
そして その計算結果がまたすごいです. 下図はRNAポリメラーゼ 6VR4 という蛋白質について,Alpha Foldが計算により決定した立体構造(青)と,実測から求めた立体構造(緑)です.

ご覧の通り,ほとんど一致しています.右上 2時の位置と,左下 7時の位置のらせん構造側鎖で少し乖離がありますが,この蛋白質の本体部分はピタリ重なっています.
このAlpha Foldで構造決定された蛋白質のデータは,インターネットで無償公開されています.誰でもこのデータを入手できます.
効く薬/効かない薬を予測できる
しかもこのin Silico=コンピュータ実験は,単に蛋白質の立体構造を求めることだけが目的ではありません.
どのような化学構造の物質であれば,有効な薬物になるのかを,わざわざ化合物を実際に合成して確かめなくても,コンピュータ上で,その『薬効』を予測できるのです.だから in Vivo,in Vitroと並べています.
講演では
- 非常によく似た構造の薬物なのに,一方は顕著な効果があって,他方では効果なし,こういう場合で なぜそうなるのか
- まったく異なる構造の化合物に,同様の薬効があるのはなぜなのか
こういうケースでは,in Silicoで 薬物の化学構造と標的となる蛋白質の構造とを突き合せることにより説明できることが解説されました.
一例としてこの論文では;

初期肺腺癌では,Stratifin という蛋白が好発し,SKP1という蛋白質と強く結合して奪い取るために癌細胞の増殖が進行するのですが,この Stratifin-SKP1の結合を妨害できる薬剤の作用を,Alph-Foldによる立体構造解析結果から説明できました.
in Vitro,すなわち試験管実験では下記の4種の化合物は,StratifinとSKP1の結合を阻害することが判明していました.
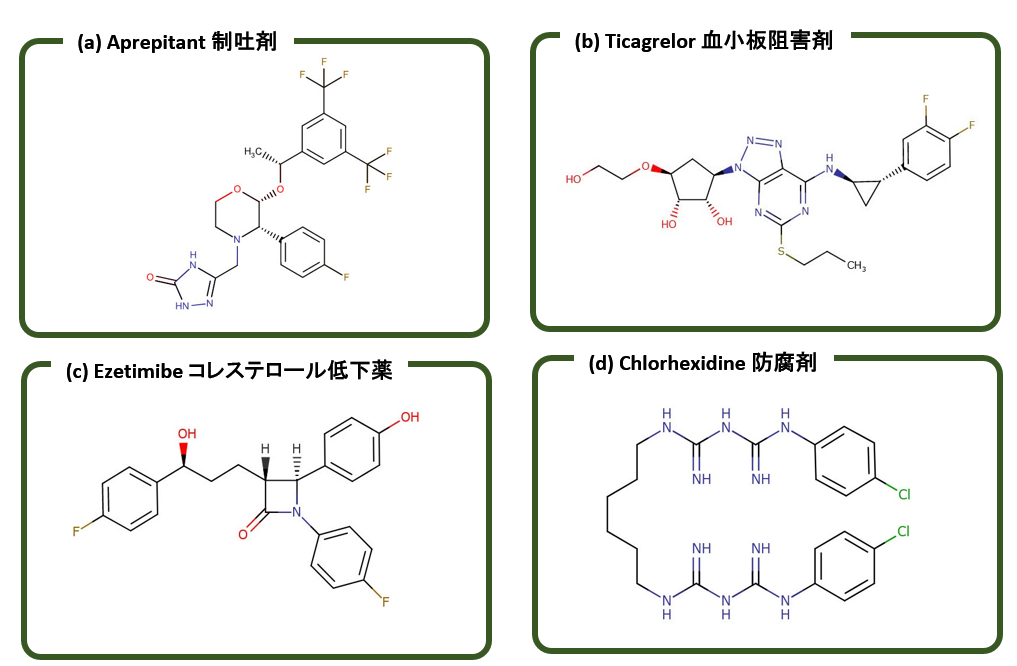
ところが,実際に in Vivo,すなわちマウスで実験したところ,前2者 (a)と (b)ではたしかに制癌作用が確認されましたが,(c)と(d)では まったく効果がなかったのです.この理由が,Alpha Foldによる解析,すなわち in Silicoで明確になりました.
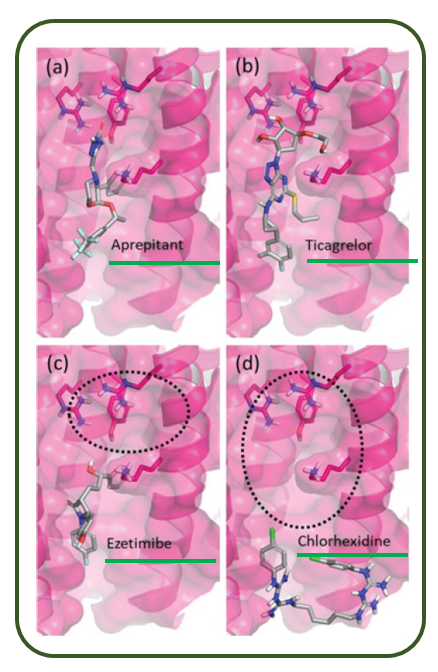
Aprepitant(a)とTicagrelor(b)という化合物は,まるで構造が異なり,しかも前者は抗血小板薬,後者は制吐薬なのですが,これらは上図の通り,Stratifinのポケットにすっぽりと収まって,SKP1との結合を妨害しうることがわかりました.つまり制癌剤として機能する可能性があると予測されたのです. 実際にこれらの化合物は,マウス実験で制癌作用が確認されています.
一方 Ezetimibe(c)とChlorhexidine(d)は in Vitroの試験管実験では,Stratifin-SKP1の結合をよく阻害したのですが,in Vivoの実際のマウス投与では制癌作用はありませんでした.それは これら2つの化合物では ポケットを完全に埋めきれていない(上図;点線部) ことで説明されます.
これらの結果を基にして さらによく効く制癌剤の探索も可能でしょう. 上記のポケットをもっと完全に塞ぐ構造の化合物にすればいいのですから. その構造さえ決まれば,あとは化学屋に『これ作っといてね』と発注するだけ.いやはや これはもう学生時代に読んだSF小説の世界すら超えています. エラい時代になったもんです.
[続く]


コメント