グルコキナーゼが血糖コントロールの重要な『センサー』であることが見出されて以来,その活性を高めれば新規な糖尿病治療薬となり得る期待が高まりました. 実際 初期には 動物細胞実験などから,下記のような簡単な構造の低分子化合物がグルコキナーゼの活性(=グルコースのリン酸化速度)を高め,マウスに投与すると 血糖値が直ちに低下することが見出されました.
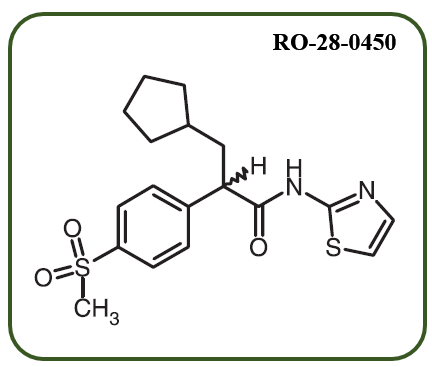
しかしこれらの化合物は たしかにグルコキナーゼに取りついて活性を高めたのですが,反面 グルコキナーゼの『低血糖では塘を取り込まない』という重要な性質を失わせてしまうものでした. グルコキナーゼは環境に応じて,即ち 低血糖状態では低活性型,高血糖状態では活性型と その構造を変化させているのですが,これらの化合物は 単に常時活性型に固定してしまうものだったからです. これでは必要のない時ですら糖を取り込むので低血糖を起こしてしまいます.そして長期投与すると,生体の防衛的な逆反応が起こって,血糖値低下効果はキャンセルされてしまいました.
グルコキナーゼの柔軟な構造変化は維持しつつ,なおかつ活性を高める必要があったのです.
この課題に系統的に取り組んだのがこの文献です.

グルコキナーゼは正常血糖値付近を境として,それより低ければ活性(=糖をリン酸化して取り込む)を下げて,それより高ければ活性を高めます.
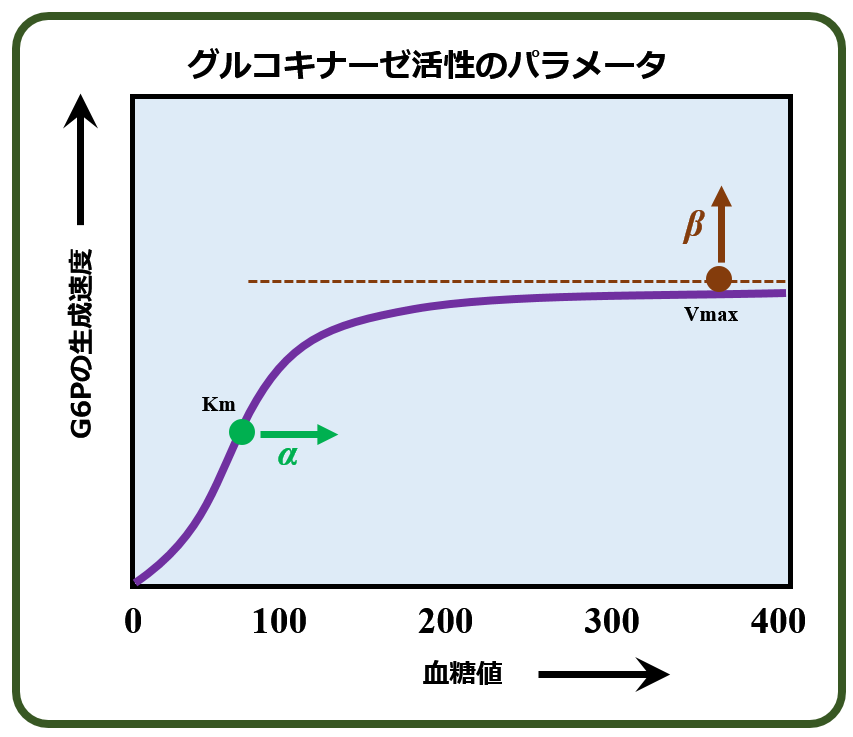
これは酵素のシグモイド(Sigmoid)特性と呼ばれるS字曲線ですが,ここで変曲点(Km)を右へ(高血糖側へ)移動させるパラメータをα,飽和速度(Vmax)を高くするパラーメータをβとして,当時の代表的なグルコーキナーゼ活性化薬1~7について;
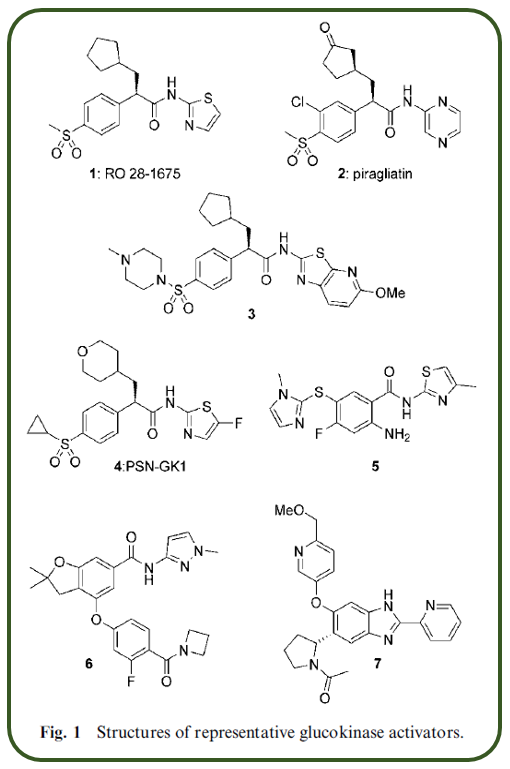
その特性を評価するとこうなりました.なお,α=1.0,β=1.0は元のグルコキナーゼと同じという意味です.
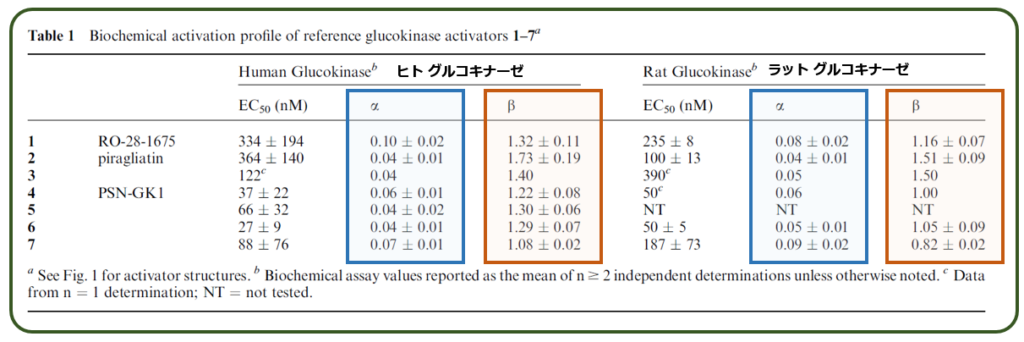
ヒト及びラットのどちらのグルコキナーゼに対しても,青で囲んだαは1よりもはるかに小さく,オレンジで囲んだβは1より大きかったのです.
そこで,種々のα及びβについて,特性がどう変わるかを計算予測したところ,
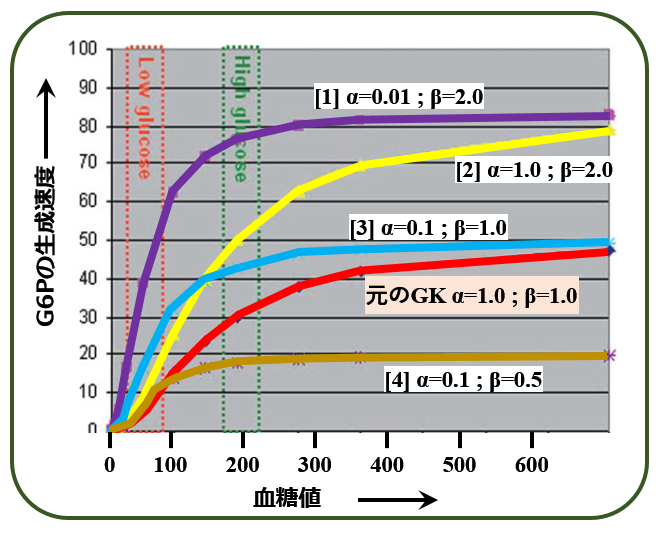
何も添加していない 自然のグルコキナーゼ(赤線;α=β=1.0)に対して,既存のグルコキナーゼ活性化薬はαが1よりはるかに小さく,βは大きいので,図の[1]の特性になると計算されました.これは実際にもそうでした. しかし,これでは 血糖値が高くても(図;緑囲み)低くても(図;オレンジ囲み)無条件に糖取り込みを高めてしまうので,低血糖を引き起こしてしまいます.
望ましいのは低血糖領域ではあまり活性を高めず,高血糖領域で高い活性を示すもの,すなわち[2]ということになります.
適度な活性に
そこで いちいちラットへの投与実験をせずとも,上記のαとβパラメータをてがかりに,細胞試験でスクリーニングしたところ,この構造(=メチルベンゾフラン)の化合物が望みの特性を持つことを見出しました.
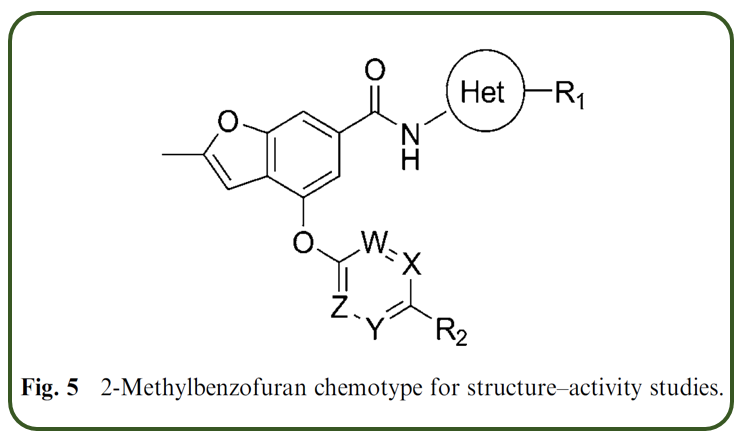
(図中,[Het]はヘテロ環を,またW,X,Y,Zは炭素又は窒素原子で,Rは何らかの置換基です)
ここから合成化学屋の力仕事になりますが,この骨格構造に該当するあらゆる化合物を合成して,そのα,βを評価しています.
合成経路の途中には収率6%などというステップもあるので,合成屋の忍耐力が試されるところです.
また,選定基準としてα,βだけでなく,実際には薬として成立するためには 適切な溶解度も必要です. 血液に全く溶けないのでは薬にならないからです.
以上の検討から最終的に最適とされた化合物が,下図の化合物No.28でした.
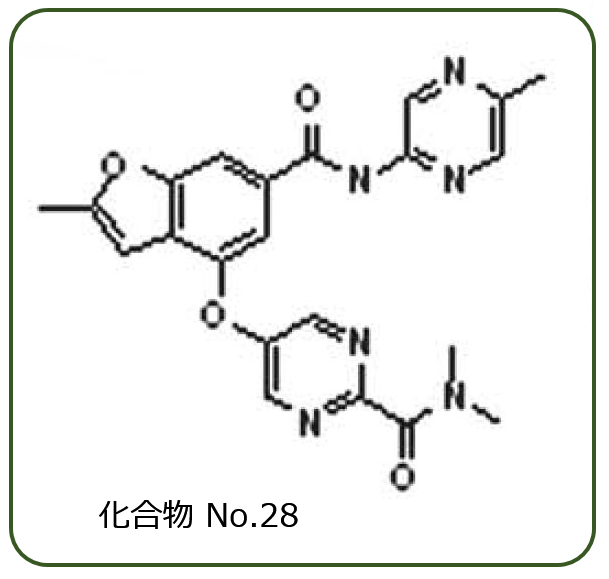
バランスがとれた
この化合物 No.28と,それまでのグルコキナーゼ活性化薬(GKA)との効果を比較したところ,こうなりました.
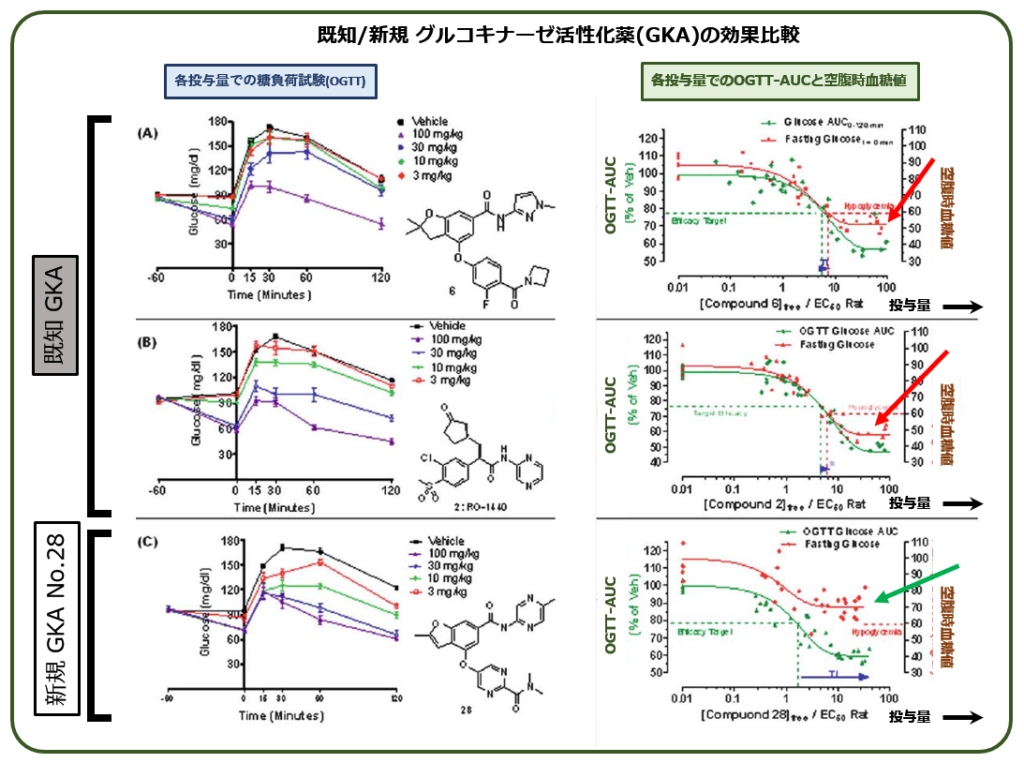
投与量を変えて,ラットに糖負荷試験(OGTT)を行った結果が左の列です.
既知のGKA2種類の結果が上段と中段,そして化合物 No.28が最下段です.どれも投与量を増やすにつれて,糖負荷試験中の血糖値が低下しています.血糖値への効果だけをみれば3種のGKAにはっきりとした差はありません.
一方右列は,OGTT中の血糖値のAUC[*](緑線)と,空腹時血糖値(赤線)を比較したものです.投与量を増やすと,既知のGKAは 40~50mg/dlと低血糖に陥ることがわかります[赤矢印]. しかし,化合物 No.28は最大投与量においても 70mg/dl程度を下回らず[緑矢印],極端な低血糖にはなりませんでした.
[*] AUC=曲線下面積
どこに張り付いたのか
化合物 No.28は,グルコキナーゼの活性は高め,なおかつ 低血糖を起こしにくいことがわかりました.では この化合物はどうしてそんなことが可能になったのでしょうか.
それはこの化合物がグルコキナーゼに張り付いた姿を見ると なんとなく納得できます.
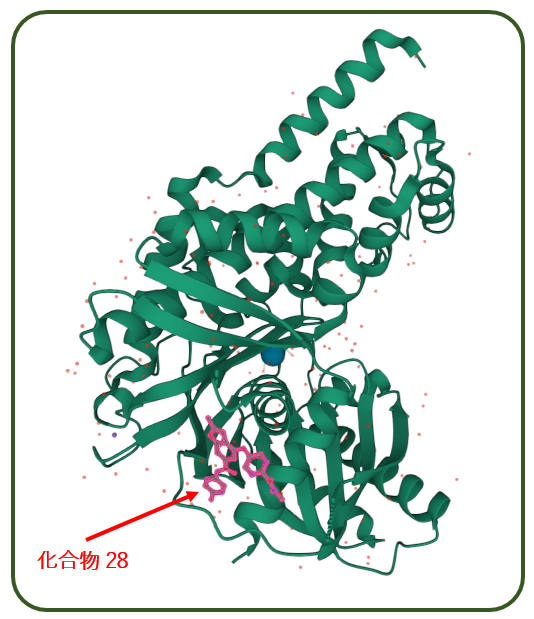
グルコキナーゼの大ドメインと小ドメインを結ぶ結合部ではなく,結合部に近い小ドメインの外側という,なんとも微妙な位置に張り付いています.おそらくこれによりグルコキナーゼの柔軟な構造変化を妨げないようにしているのでしょう.
ここで見出された化合物 No.28は,高血糖を抑制し,しかも低血糖を起こさない,したがって長期の投与でも 血糖低下効果を失わないと期待されます.
光明は見えてきたのです.
[続く]


コメント