前回記事では,グルコキナーゼ活性化薬 MK-0941がなぜうまくいかなかったのかについて,2つの『疑問』をとりあげましたが;
- (1)なぜ 本来のグルコキナーゼは『低血糖ではグルコースを取り込まず』,『高血糖になった時だけすばやくグルコースを取り込む』という 絶妙な動作ができるのか
- (2) MK-0941(だけでなく,初期に開発された グルコキナーゼ活性化薬はほとんどすべてそうなのですが)が,グルコキナーゼのどこにどのように働きかけて動作特性をガラリと変えてしまったのか.
(1)の疑問は解決しました. グルコキナーゼは高血糖状態では【活性型】,低血糖状態では【不活性型】と,環境に応じて自ら活性を変化させているのです.
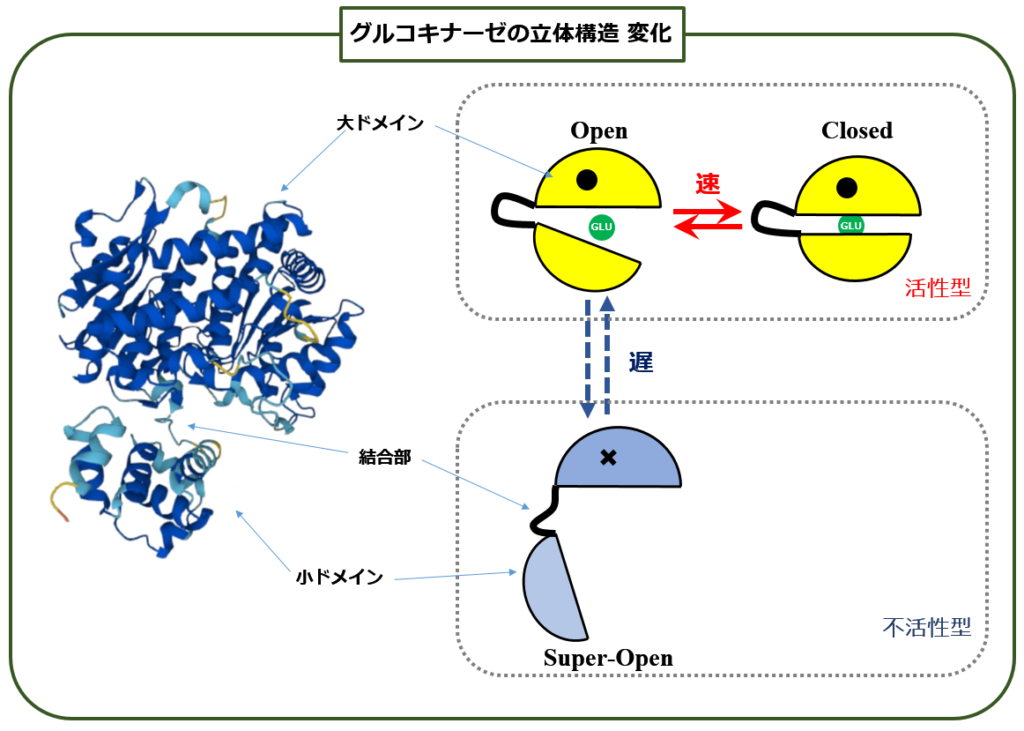
グルコキナーゼの上あご(=大ドメイン)と下あご(=小ドメイン)とは,ゆるい紐(=結合部)で結ばれており,もっとも安定な状態は 上図のSuper-Open型という,いかにもリラックスした形なのです. この状態ではほとんどグルコースを取り込みません. しかし 周囲のグルコースが多くなると(=血糖値が高くなると)俄然顎を引き締めて,パックマン(死語か?)のように猛烈な勢いでグルコースを取り込みます.
この状態では グルコキナーゼは Open型とClosed型を往復するだけであり,血糖値が下がるまではSuper-Open型には戻りません.
休ませてくれない
では(2)の疑問はどう考えればいいのでしょうか.
これもKamata論文で推察されています.

this structural information is indicative of the activation mechanism of compound A. It is apparent that binding of compound A to the allosteric site sterically inhibits the release of the α13 helix from the small domain. As result, glucokinase is unable to change to the super-open conformation and can exist only in the open or closed forms even at low concentrations of glucose, as is observed for hexokinase I.
この構造情報は化合物Aの活性化機構を示唆している。化合物A[注:グルコキナーゼ活性化化合物]がアロステリック部位に結合すると、α13らせんが小ドメインから遊離することが立体的に抑制されることが明らかであった。その結果、グルコキナーゼはSuper-Open型に変化することができなくなり、ヘキソキナーゼIに見られるように、低血糖値状態であってもOpen型またはClosed型しか存在しなくなる。
2004 Kamata
つまり,MK-0941など初期のグルコキナーゼ活性化薬は,グルコキナーゼの変幻自在な型変化を可能にしていた柔軟な構造を固定してしまったので,グルコキナーゼが非活性型に戻れなくなり,血糖値の高低とは無関係に常時活性型となってしまう,だから活性が著しく高くなったのだというわけです.文献にはありませんが,図にすればこういうことでしょう.
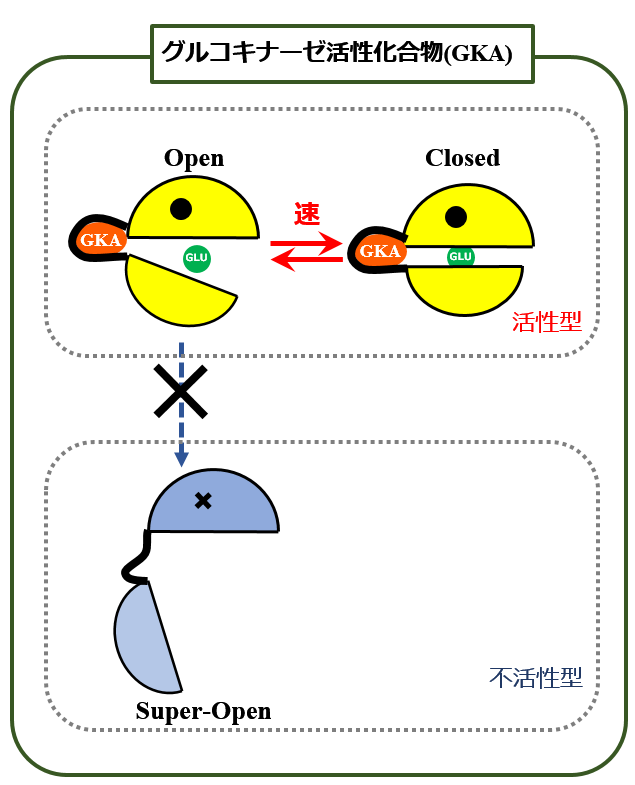
(グルコキナーゼの付着部位が結合部とは限りません)
これで MK-0941が投与直後には すばらしい血糖値低下効果を発揮した理由が説明できます,同時に その効果が継続しなかった理由も納得できます.
血糖値とはお構いなしに無制限にグルコースを取り込んでいった結果,ついに肝臓のグリコーゲン処理能力がパンクして 逆反応が起こり,長期投与ではMK-0941の効果が見かけ上キャンセルされていったわけです.
であれば,さてどうすればいいのでしょうか.
[続く]


コメント