【追記】
このシリーズ記事に highbloodglucose様のブログにて,強力な助っ人コラボ企画が掲載されております.

以下,青字部分は このコラボ企画でご指摘いただいた点について 追記したものです.
Bozec博士らのグループは,イメグリミンの作用機序を解明するために,以下のような動物実験の結果を報告しています.

実験プロトコル
イメグリミンを開発したPoxel社はフランスの製薬会社ですので,この実験はフランス国内で行われています. したがって用いた実験動物・材料もすべてフランス製です.
実験動物にはHarlan社の C57BL/6JOlaHsdというマウスを用いています.

そう言われると 何となくフランスっぽい顔立ちです(←ウソ).
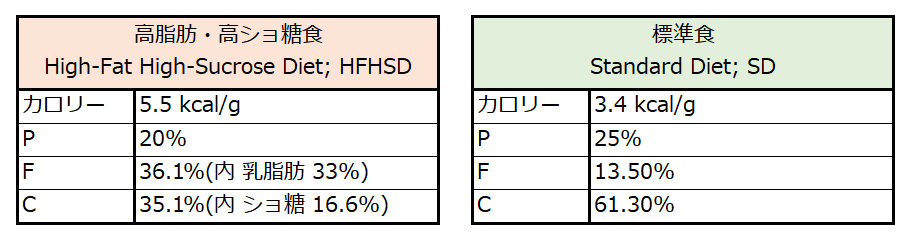
実験動物はまず2群に分けています.通常食(SD; Standard Diet)で飼育する群と,高脂肪・高ショ糖食(High-Fat High-Sucrose Diet; HFHSD)で飼育する群です.
『高脂肪・高ショ糖食』というのは 聞きなれないですが,通常の飼料よりも高脂質にして,かつ炭水化物の1/2を砂糖に置き換えた高カロリー食のことであり(下表 左),つまりはメタボ食です.
これに対して通常食は,ほぼ世界共通でこういう割合です(下表 右).
高カロリーの『高脂肪・高ショ糖食』HFHSD を与えられたマウスは,当然 肥満していきます.
16週間の飼育期間の最後の6週間にイメグリミン(200mg/kg)又は (プラセボとして)単なるメチルセルロースの水溶液を投与します.

以下,通常食で飼育された群を【SD群】,『高脂肪・高ショ糖食』でかつイメグリミンを投与された群を【投与群】,『高脂肪・高ショ糖食』で飼育されたがイメグリミンを投与されなかった群を【対照群】と表記します.
なお,各群の体重の変化は以下の通りです.
【SD群】飼育期間を通じて 微増:22g →25g
【対照群】第10週まで直線的に増加:20g→42g 以降フラット
【投与群】第10週まで直線的に増加:20g→42g 投与開始後微減:42g→40g
耐糖能改善
まず 各群の糖負荷試験(経口ではなく,腹腔にブドウ糖を注射する 強制腹腔糖負荷試験)を行って,それぞれの耐糖能を確認しています.
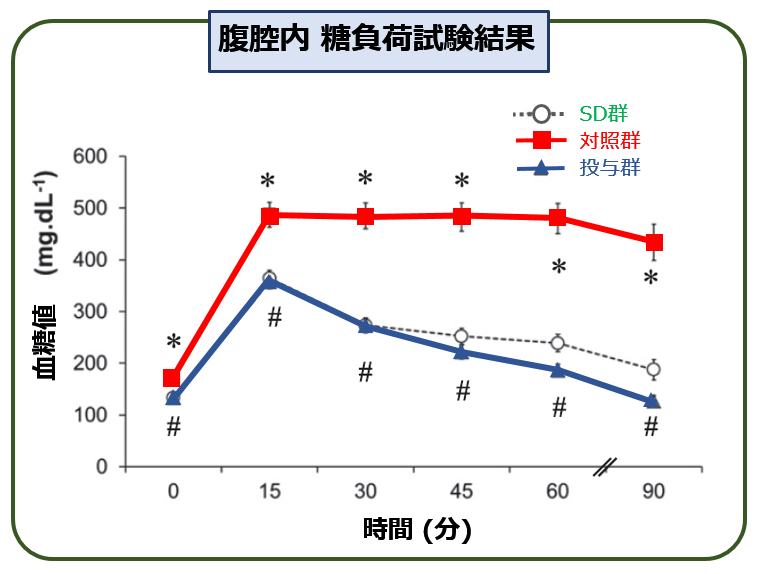
イメグリミンを投与されたマウス(=【投与群】)の耐糖能は,【対照群】に比べて大きく改善しており,正常な【SD群】と差がありません. ここを確認したうえで,次に それがミトコンドリア機能改善とどのように結びついているのかを調べています.
【追記】
ところで,この糖負荷試験の15分のデータを見ると,【投与群】のインスリン分泌量,C-ペプチド量は,【SD群】よりも【対照群】よりも大幅に増加しています.
15分血糖値は正常なのですから,この結果を見ると『インスリン抵抗性が更に増大した』ともみえますし,『高血糖に即応したインスリン分泌の増大』とも言えます.
ところが糖負荷試験とは別に,腹腔にインスリンを注射する「インスリン負荷試験」も行っていて,その結果では【投与群】は【SD群】とほぼ同様に血糖値は下がっているので『【投与群】のインスリン感受性は向上した』とも解釈できます.
ものは言いようで,どのようにでも解釈できてしまうので判断に悩むところです.
ミトコンドリア機能
前回記事にもまとめましたたように,
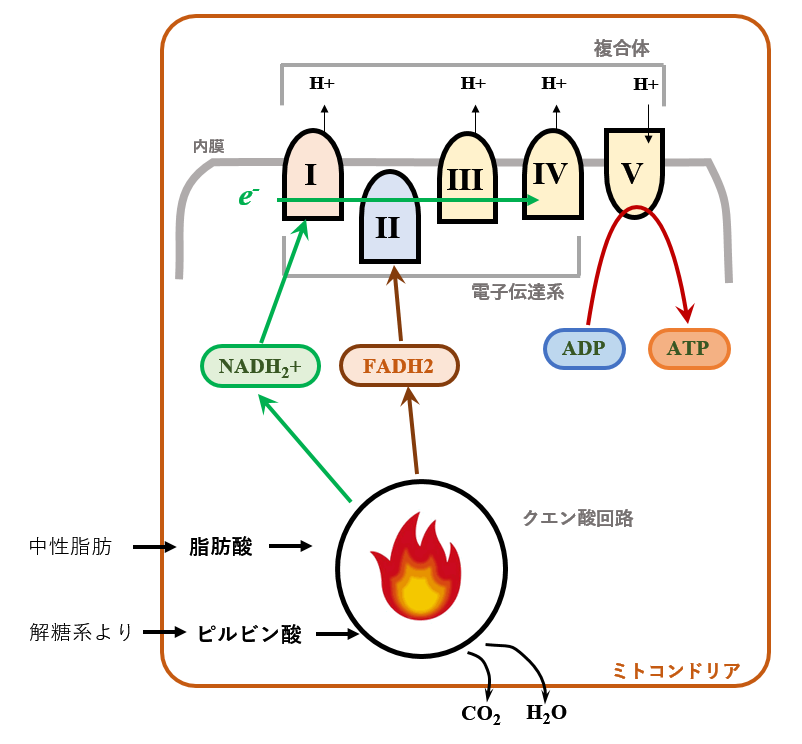
ミトコンドリアの中では,クエン酸回路(TCA)が,中性脂肪由来の脂肪酸や,ブドウ糖由来のピルビン酸を酸化して,その時発生するエネルギーで NADH2+とFADH2という2種類の水素輸送体が合成されます.前者のNADH2+は 電子伝達系の複合体Iに,後者のFADH2は複合体IIに送られて,ADP→ATP変換のエネルギーの源となります.
火に油
火に油を注げば,炎は激しく燃え上がります.

これを逆にみれば,炎に何かをぶっかけて燃え上がれば,それは『油』だったということになります(よい子は真似をしてはいけません)
そこで,上記のように準備された 3グループ(=【SD群】【投与群】【対照群】)のマウスの肝臓からミトコンドリアだけを単離して,ミトコンドリアの呼吸の様子,具体的には酸素の消費速度を微小電極を用いて測定しています.
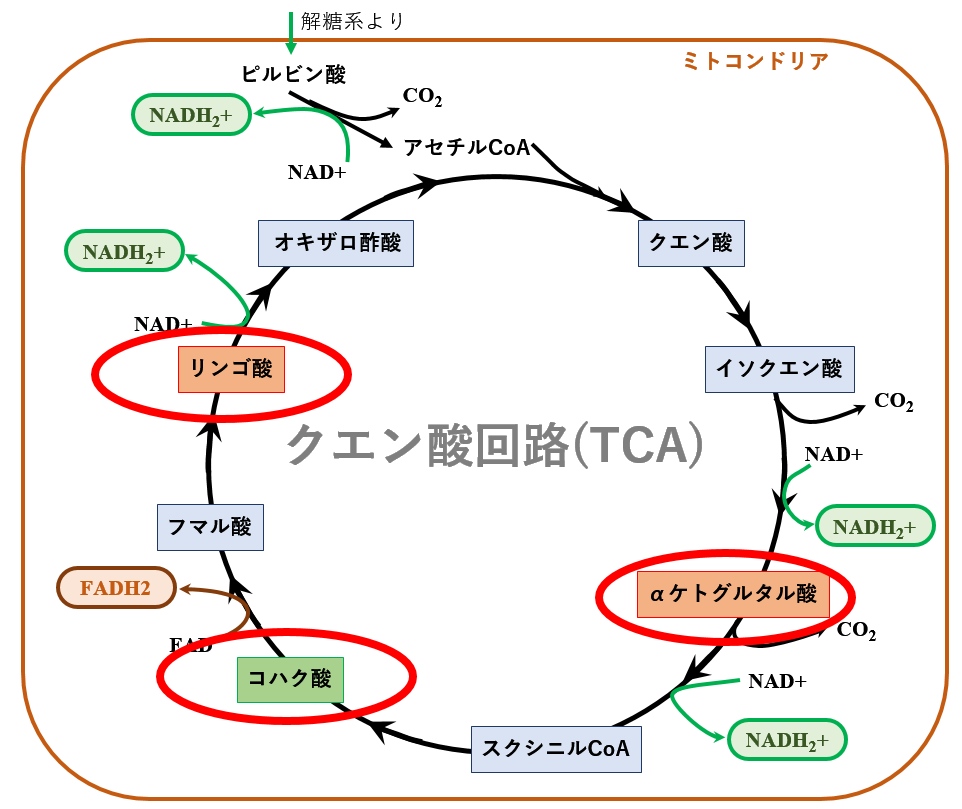
測定にあたり,ミトコンドリアの『油』となる基質を二種類用意しています.一つは [グルタミン酸とリンゴ酸の混合物],もう一つは[コハク酸]です. リンゴ酸とコハク酸とは,クエン酸回路の中に登場していたことを思い出してください[下図].
またグルタミン酸は,酵素により容易にαーケトグルタル酸に転換されます. 本来であれば,基質としてαーケトグルタル酸そのものを使いたいのですが,これは不安定な化合物なのでその前駆体であるグルタミン酸として添加しています.
実験は
- これらの基質がまったく存在しない場合,【基質なし】
- 基質として[グルタミン酸とリンゴ酸の混合物]を与えた場合,又は[コハク酸]を与えた場合,【基質あり】
それぞれの場合での酸素消費率を測定しています.
実際の実験では,各基質存在下で培養しているミトコンドリアに,ADPを添加して その時の酸素消費率の変化を測定しています.
そして実験の最後に,(ミトコンドリアの呼吸による酸素消費を間違いなく測定していたことの証明として)オリゴマイシンを添加して,酸素消費が停止することを確認しています【停止確認】
オリゴマイシンはミトコンドリア電子伝達系の阻害剤です.
その結果はこうなりました.
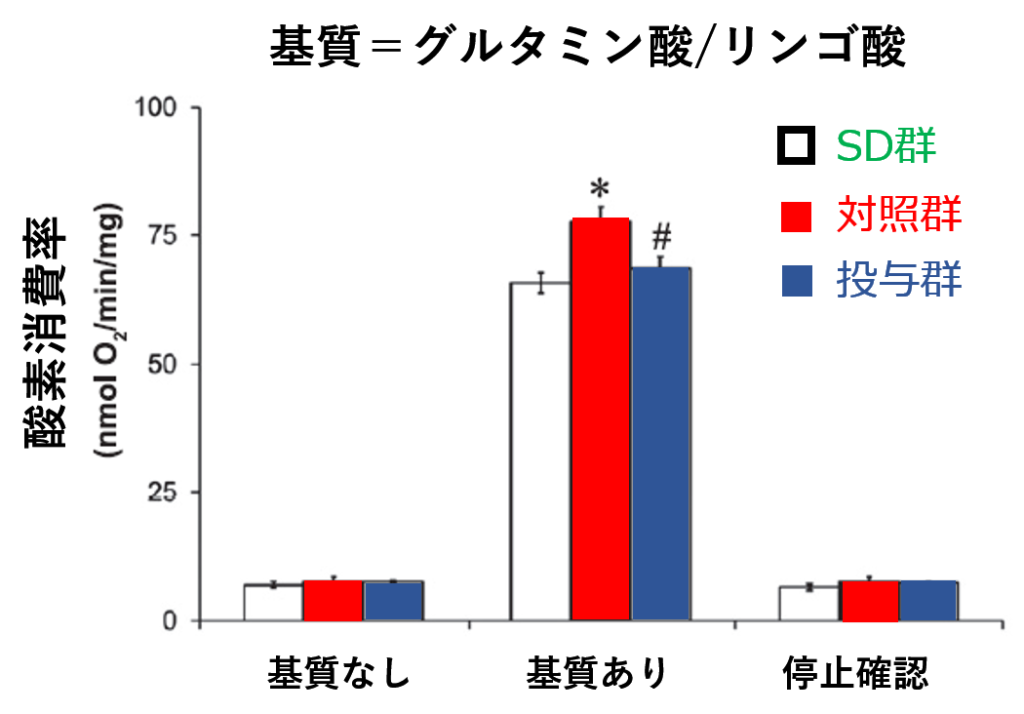
この結果を見ると,イメグリミンを投与された【投与群】は,グルタミン酸(=すなわち α-ケトグルタル酸)やリンゴ酸という,NADH2+の放出を促進する基質が豊富な時には,正常マウス【SD群】とほぼ同等の酸素消費率です.しかし,イメグリミンを投与されていない肥満マウス【対照群】では,著しく酸素消費が増えています. NADH2+は,電子伝達系の複合体Iで受け取られるものですから,
イメグリミンは 相対的には 複合体Iを抑制しているといえます.
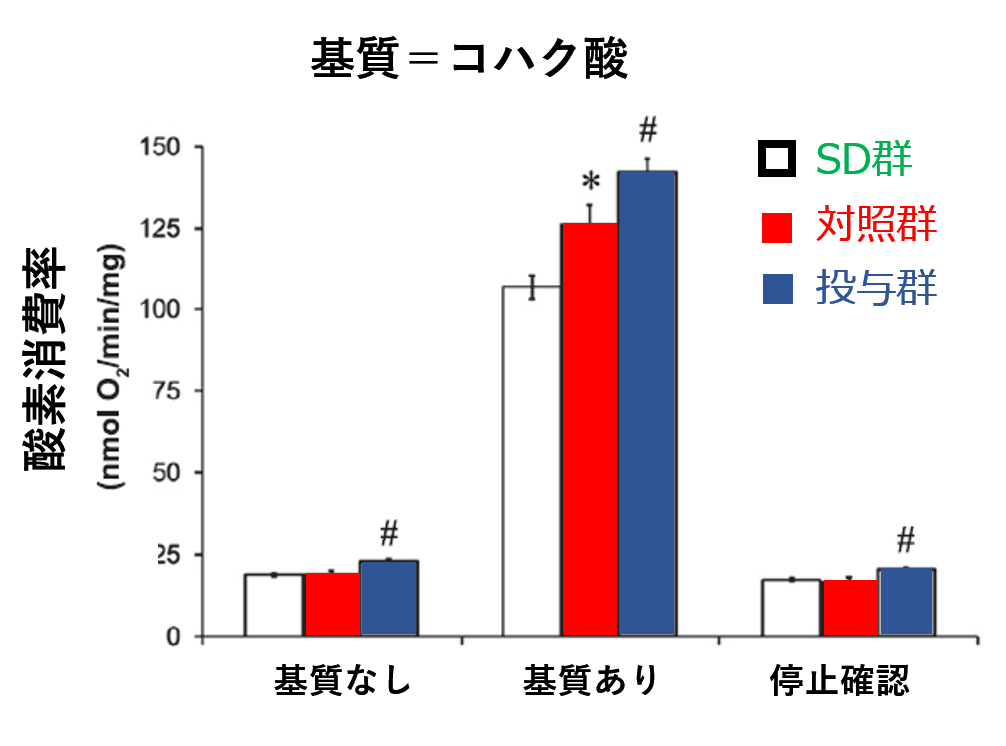
一方,コハク酸が豊富な場合には,【投与群】は【SD群】や【対照群】よりも激しく呼吸していました. コハク酸→フマル酸のプロセスで作られるのは FADH2であり,これは 複合体IIで受け取られますから,
イメグリミンは 複合体IIを活性化していると示唆されます.
脂肪肝をみると
【SD群】【対照群】【投与群】,それぞれの肝臓の脂肪細胞をみると,こうなっていました.

メタボ食で肥満した【対照群】[中]は,肝臓に脂肪が蓄積していますが,【投与群】[右]は 脂肪が少なく,正常な【SD群】[左]に近くなっています.
結論
結論として,著者は以下のような推論をたてています.
メタボ食により肥満した【対照群】マウスは,遊離脂肪酸のβ酸化が亢進し,ミトコンドリアの複合体Iが活性化されることから,活性酸素の発生が多くなり,これがインスリン抵抗性の増大/耐糖能の悪化を招いている.
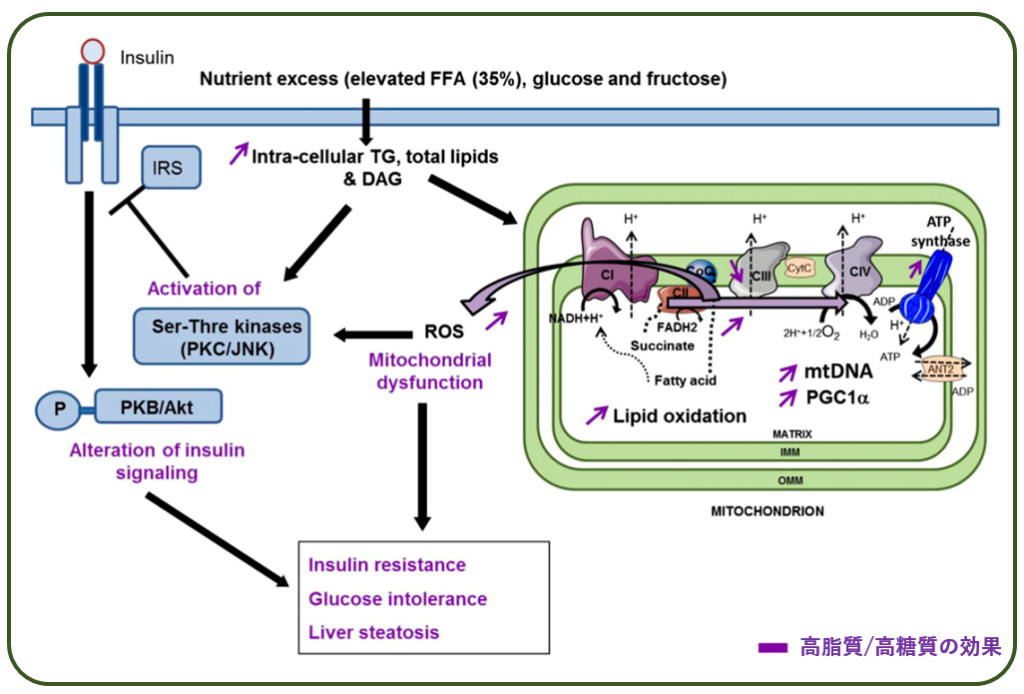
しかし,イメグリミン投与により,ミトコンドリアの複合体Iの活動は抑制され,代わりに複合体IIがその役割を肩代わりして,結果として活性酸素増大を防いで耐糖能を改善している.
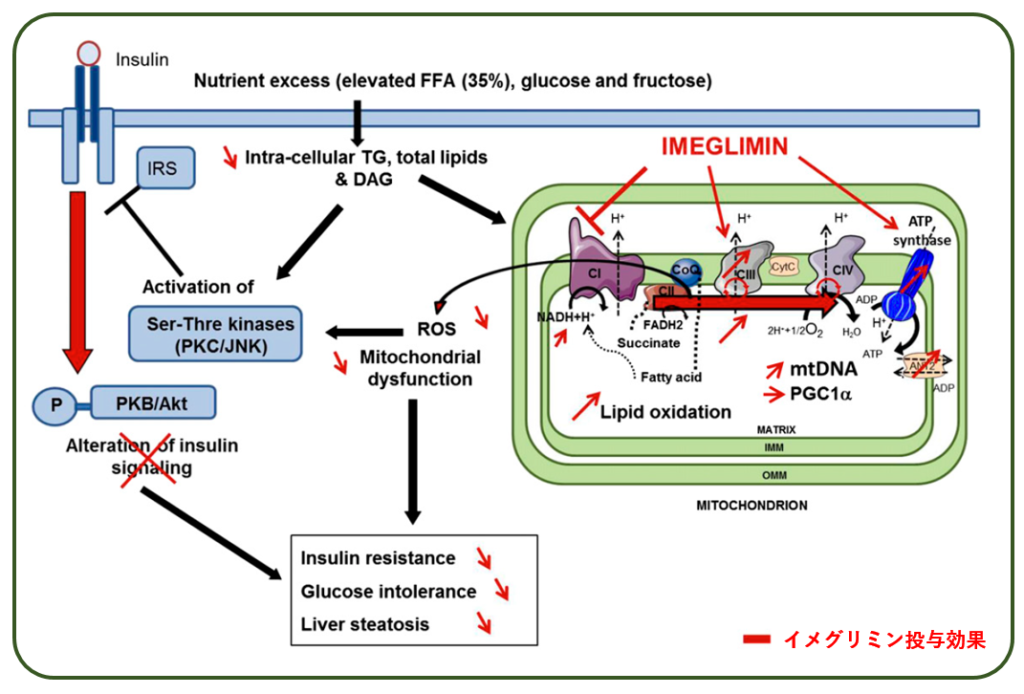
以上の推論は,この記事で紹介したデータだけでなく,論文中では,基質の違いによる活性酸素(過酸化水素)生成速度の差や,肝臓発現酵素の様子なども根拠としています.
もちろん,ここで提案されたイメグリミンの作用機序は,動物実験から得られた 一つの仮説にすぎません.
メトホルミンの作用機序すら,登場から60年もたっているのに まだ完全解明にはほど遠いのですから,イメグリミンの作用機序が明らかになるのは,まだまだ時間がかかるでしょう.
また イメグリミンには,メトホルミンのような『腸で作用する』効果があるのかないのかも,現時点ではまったく不明です.
そこで,次にメトホルミンとイメグリミンは,何が似ていて 何が違うのかを考えてみます.
[6]に続く


コメント
イメグリミン面白いなぁ〜と思ってコメントを書き始めたのですが、なんだかとても長くなってしまいそうなので、自分のブログ記事にしちゃいました。
考え出したらわけが分からなくなって、こんがらがってきました。
ミトコンドリア、難しすぎる… orz
コラボ企画ありがとうございます.
ご指摘の点は 追記しました. なお,この論文とは別報告ですが,2型糖尿病患者を対象にした高血糖クランプ実験で,イメグリミン投与者では ブドウ糖静注と同時にインスリン増加が観測されています.
>ミトコンドリア、難しすぎる
クエン酸回路はすべてがメリーゴーランドのようにつながっているので,一部が亢進しても全体のサイクル収支が不変であれば,結局 回路の回転速度の大小だけとなるでしょうね. まったく頭が痛くなります.
追記をありがとうございます!
体重はイメグリミン群で微減だったのですね。
だけど脂肪肝は解消されているということは、やせるほどには至っていないけれど、異所性の脂肪は正常に代謝されるようになった、ということなんですかね。
そして、体重はあまり変化していないけど、耐糖能は劇的に改善。
>糖負荷試験の15分のデータを見ると,【投与群】のインスリン分泌量,C-ペプチド量は,【SD群】よりも【対照群】よりも大幅に増加
インスリン分泌はイメグリミンで大幅増加なんですね。
インスリン分泌は糖負荷後15分しか見ていないのでしょうか。
たとえば、15分後はドカンと増加しても、それで血糖値が下がることで、30分後にはインスリン分泌がぐっと減少していれば、グルコース感受性が高まって初期分泌が改善されたということになりそうです。
SD群と対照群との違いはどうだったのでしょう? 普通に考えたら、肥満の対照群では高インスリン血症になっていそうです。そうだとすると、イメグリミン投与でさらなる高インスリン血症になるということですよね。
一瞬の高インスリンならいいですが、持続して高インスリンなら、ちょっと微妙だなぁ…
>「インスリン負荷試験」も行っていて,その結果では【投与群】は【SD群】とほぼ同様に血糖値は下がっている
うーん、なるほど。
少なくとも言えることは、インスリン分泌も増やすし、インスリン抵抗性も改善する。
両方の作用によって、耐糖能が劇的に改善している。
ということでしょうか。
ミトコンドリア(クエン酸回路、電子伝達系)について、本当に理解が足りてないな〜と実感します。
たとえば、ブログ記事中の「高脂質/高糖質の効果」「イメグリミン投与効果」の図がありますよね? この中で、ミトコンドリアマトリックスの中にあるFatty acidから、複合体I(NADH+H+)とコエンザイムQに向かって点線が描かれていますよね? これが理解できませんできず、昨日、自分のブログ記事を書いたときも理解していませんでした。
今日、もう一度ゆっくり考えていて、β酸化のことを失念していたことに気づきました。
それで、私のブログ記事に追記しておきました。
クエン酸回路を上手く使えないとなると、必要なATPを作るためにはβ酸化を亢進させる必要があるわけですね。
となると、使い道のないアセチルCoAが余ってしまいますが、余ったアセチルCoAはいずこに?
うーん、また謎が謎を生んでしまった… orz
>普通に考えたら、肥満の対照群では高インスリン血症
グラフから読み取れる限りでは,それぞれの群のインスリン分泌量(pmol/l)は;
T=0
SD群:60
対照群: 600
投与群: 550
T=15min.
SD群:100
対照群: 600
投与群: 1100
くらいで,イメグリミンで大量にインスリンが増えています. しかし,おっしゃる通り
>インスリン分泌は糖負荷後15分しか見ていない
それ以外の時間でどうなのか, INS_AUCはどうなのか,そこが問題ですよね.しかし記載も説明もありませんでした.
ところが C-ペプチドを見ると,やはりグラフの目分量値(pmol/l)では;
T=0
SD群:400
対照群: 1200
投与群: 1000
T=15min.
SD群:600
対照群: 1300
投与群: 1800
となっており,以上のことから 著者は,対照群ではT=0→15の高血糖変化に インスリン,C-ペプチドが応答できていないのに対して,投与群ではどちらも血糖値上昇にレスポンスできている(そして 血糖値上昇を防いでいる)のだから グルコース応答性が改善されたのだと説明しています.
>使い道のないアセチルCoAが
私は単純にどんどんケトン体にして放り出されていくのだろうと思いました.